Τι είναι η άνοδος και η κάθοδος - μια απλή εξήγηση
Ηλεκτροχημεία και ηλεκτρολυτική επιμετάλλωση
Υπάρχουν δύο κύριες ενότητες στην ηλεκτροχημεία:
- Γαλβανικά κύτταρα - η παραγωγή ηλεκτρικής ενέργειας μέσω χημικής αντίδρασης. Αυτά τα στοιχεία περιλαμβάνουν μπαταρίες και συσσωρευτές. Συχνά ονομάζονται πηγές χημικών σημάτων.
- Ηλεκτρόλυση - ο αντίκτυπος σε μια χημική αντίδραση με ηλεκτρισμό, με απλά λόγια - με τη βοήθεια μιας πηγής ισχύος, ξεκινά μια αντίδραση.
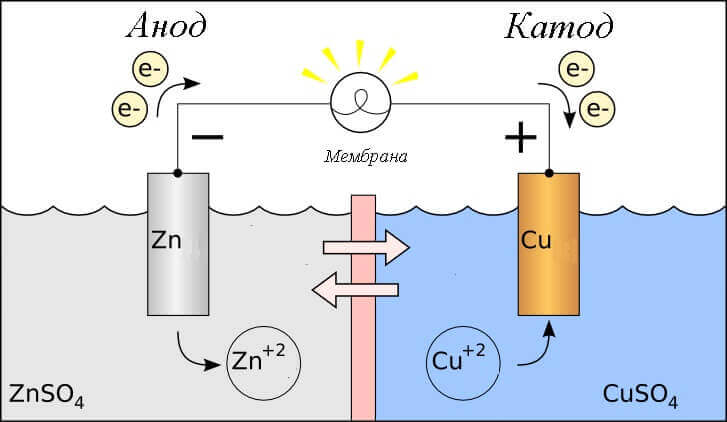
Εξετάστε την αντίδραση οξειδοαναγωγής σε ένα γαλβανικό κύτταρο, τότε ποιες διαδικασίες συμβαίνουν στα ηλεκτρόδια του;
- Ανοδος - το ηλεκτρόδιο στο οποίο παρατηρείται οξειδωτική αντίδρασηδηλαδή, αυτόςδίνει ηλεκτρόνια. Το ηλεκτρόδιο στο οποίο λαμβάνει χώρα η αντίδραση οξείδωσης καλείται αναγωγικό μέσο.
- Κάθοδος - το ηλεκτρόδιο στο οποίο ρέει αντίδραση ανάκτησηςδηλαδή, αυτόςδέχεται ηλεκτρόνια. Το ηλεκτρόδιο στο οποίο λαμβάνει χώρα η αντίδραση μείωσης καλείται μέσο οξείδωσης.
Αυτό θέτει το ερώτημα - πού είναι το πλεονέκτημα και πού είναι το μείον της μπαταρίας; Με βάση τον ορισμό ενός γαλβανικού κυττάρου η άνοδος δίνει ηλεκτρόνια.
Σπουδαίος! Το GOST 15596-82 δίνει έναν επίσημο ορισμό των ονομάτων των συμπερασμάτων των πηγών χημικού ρεύματος, εν συντομία, στη συνέχεια συν στην κάθοδο και μείον στην άνοδο.
Σε αυτήν την περίπτωση, λαμβάνεται υπόψη η ροή ηλεκτρικού ρεύματος. κατά μήκος του αγωγού του εξωτερικού κυκλώματος από οξειδωτής (κάθοδος) προς την αναγωγικό (άνοδος). Δεδομένου ότι τα ηλεκτρόνια στο κύκλωμα ρέουν από μείον σε συν, και το ηλεκτρικό ρεύμα είναι το αντίστροφο, τότε η κάθοδος είναι συν και η άνοδος είναι μείον.
Προσοχή: το ρεύμα ρέει πάντα στην άνοδο!
Ή το ίδιο στο διάγραμμα:
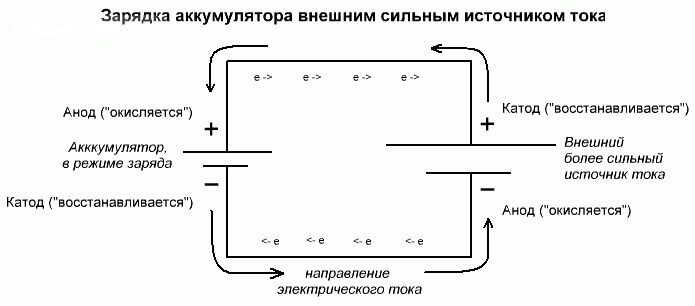
Διαδικασία ηλεκτρόλυσης ή φόρτισης μπαταρίας
Αυτές οι διαδικασίες είναι παρόμοιες και αντίστροφες με το γαλβανικό κύτταρο, αφού εδώ δεν προέρχεται ενέργεια από μια χημική αντίδραση, αλλά μάλλον - μια χημική αντίδραση συμβαίνει λόγω μιας εξωτερικής πηγής ηλεκτρικής ενέργειας.
Σε αυτήν την περίπτωση, συν το τροφοδοτικό ονομάζεται επίσης κάθοδος και μείον την άνοδο. Αλλά οι επαφές του επαναφορτιζόμενου γαλβανικού κυττάρου ή των ηλεκτροδίων του ηλεκτρολύτη θα έχουν ήδη αντίθετα ονόματα, ας δούμε γιατί!
Σπουδαίος! Όταν ένα γαλβανικό στοιχείο αποφορτίζεται, η άνοδος είναι αρνητική, η κάθοδος είναι συν και αντίστροφα κατά τη φόρτιση.
Δεδομένου ότι το ρεύμα από το θετικό τερματικό της πηγής τροφοδοσίας τροφοδοτείται στο θετικό τερματικό της μπαταρίας, το τελευταίο δεν μπορεί πλέον να είναι κάθοδος.Αναφερόμενος στα προηγούμενα, μπορούμε να συμπεράνουμε ότι σε αυτήν την περίπτωση τα ηλεκτρόδια της μπαταρίας αλλάζουν υπό όρους κατά τη φόρτιση.
Στη συνέχεια, μέσω του ηλεκτροδίου ενός φορτισμένου γαλβανικού στοιχείου στο οποίο ρέει ένα ηλεκτρικό ρεύμα, ονομάζεται άνοδος. Αποδεικνύεται ότι κατά τη φόρτιση της μπαταρίας, το συν γίνεται άνοδο και μείον την κάθοδο.
Ηλεκτρολυτική επιμετάλλωση
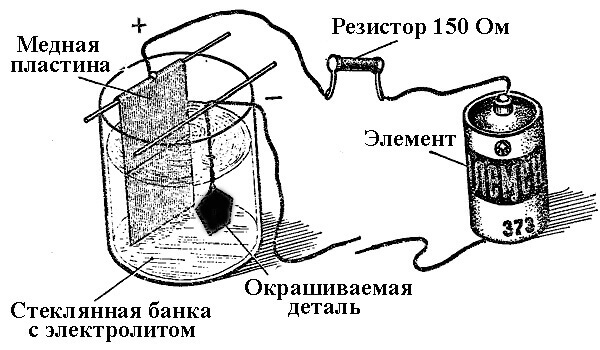
Οι διαδικασίες εναπόθεσης μετάλλων ως αποτέλεσμα μιας χημικής αντίδρασης υπό την επίδραση ενός ηλεκτρικού ρεύματος (κατά τη διάρκεια της ηλεκτρόλυσης) ονομάζονται γαλβανική μηχανική. Έτσι, ο κόσμος έλαβε ασημένια, επιχρυσωμένα, επιχρωμιωμένα ή άλλα επιχρυσωμένα κοσμήματα και λεπτομέρειες. Αυτή η διαδικασία χρησιμοποιείται τόσο για διακοσμητικούς όσο και για εφαρμοσμένους σκοπούς - για τη βελτίωση της αντοχής στη διάβρωση διαφόρων εξαρτημάτων και συγκροτημάτων μηχανισμών.
Η αρχή της λειτουργίας των εγκαταστάσεων ηλεκτρολυτικής επίστρωσης έγκειται στη χρήση διαλυμάτων αλατιού των στοιχείων που θα καλύπτουν το μέρος ως ηλεκτρολύτη.
Στην ηλεκτρολυτική επίστρωση, η άνοδος είναι επίσης ένα ηλεκτρόδιο στο οποίο συνδέεται η θετική έξοδος της πηγής ισχύος, αντίστοιχα, η κάθοδος στην περίπτωση αυτή είναι μείον. Σε αυτήν την περίπτωση, το μέταλλο εναποτίθεται (μειωμένη) στο αρνητικό ηλεκτρόδιο (αντίδραση αναγωγής). Δηλαδή, εάν θέλετε να φτιάξετε ένα επιχρυσωμένο δαχτυλίδι με τα χέρια σας, συνδέστε την αρνητική έξοδο του τροφοδοτικού και τοποθετήστε το σε ένα δοχείο με την κατάλληλη λύση.
Στα ηλεκτρονικά
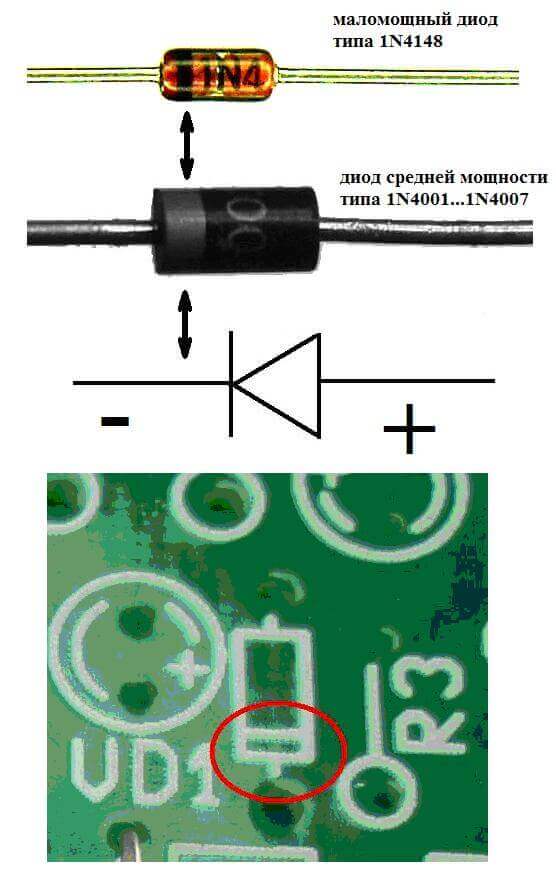
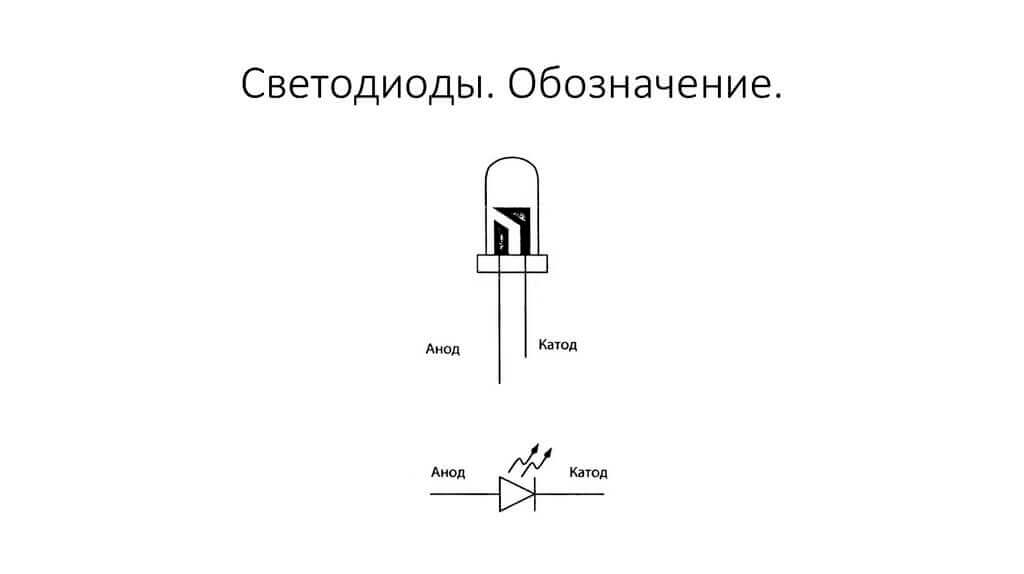
Τα ηλεκτρόδια ή τα σκέλη των ημιαγωγών και ηλεκτρονικών συσκευών κενού ονομάζονται επίσης συχνά άνοδος και κάθοδος. Εξετάστε την υπό όρους γραφική ονομασία μιας διόδου ημιαγωγού στο διάγραμμα:
Όπως βλέπουμε, η άνοδος της διόδου συνδέεται με το συν της μπαταρίας. Ζητείται έτσι για τον ίδιο λόγο - σε αυτήν την περίπτωση, το ρεύμα ρέει στην έξοδο της διόδου σε κάθε περίπτωση. Σε ένα πραγματικό στοιχείο στην κάθοδο υπάρχει μια σήμανση με τη μορφή μιας λωρίδας ή μιας κουκκίδας.
Το LED είναι παρόμοιο. Σε LED 5 mm, τα εσωτερικά είναι ορατά μέσω της φιάλης. Το μισό που είναι μεγαλύτερο είναι η κάθοδος.
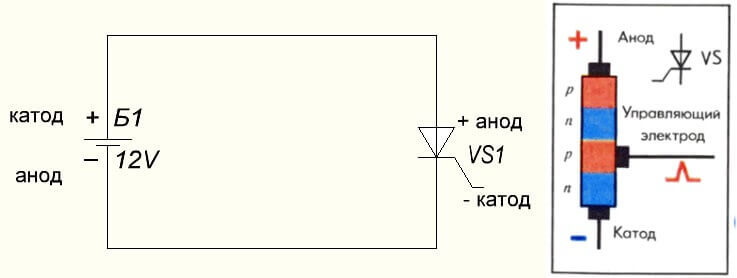
Η κατάσταση είναι επίσης με τον θυρίστορ, ο σκοπός των συμπερασμάτων και η «μονοπολική» εφαρμογή αυτών των τριών ποδιών συστατικών το καθιστούν μια ελεγχόμενη δίοδο:
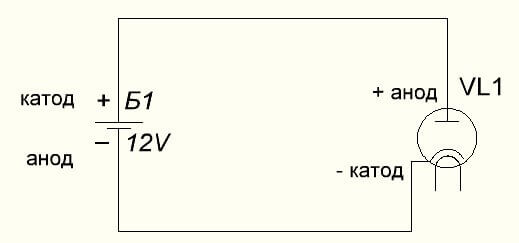
Η δίοδος κενού συνδέει επίσης την άνοδο με το συν και την κάθοδο με το αρνητικό, το οποίο φαίνεται στο παρακάτω διάγραμμα. Αν και όταν εφαρμόζεται αντίστροφη τάση, τα ονόματα αυτών των στοιχείων δεν θα αλλάξουν, παρά τη ροή του ηλεκτρικού ρεύματος στην αντίθετη κατεύθυνση, αν και ασήμαντη.
Με παθητικά στοιχεία όπως πυκνωτές και αντιστάσεις, αυτό δεν συμβαίνει. Η κάθοδος και η άνοδος δεν απομονώνονται ξεχωριστά από την αντίσταση · το ρεύμα σε αυτό μπορεί να ρέει προς οποιαδήποτε κατεύθυνση. Μπορείτε να δώσετε οποιοδήποτε όνομα στα συμπεράσματά του, ανάλογα με την κατάσταση και το σχετικό σχέδιο. Συμβατικοί μη πολικοί πυκνωτές επίσης. Λιγότερο συχνά, αυτός ο διαχωρισμός των ονομάτων επαφών παρατηρείται σε ηλεκτρολυτικούς πυκνωτές.
Συμπέρασμα
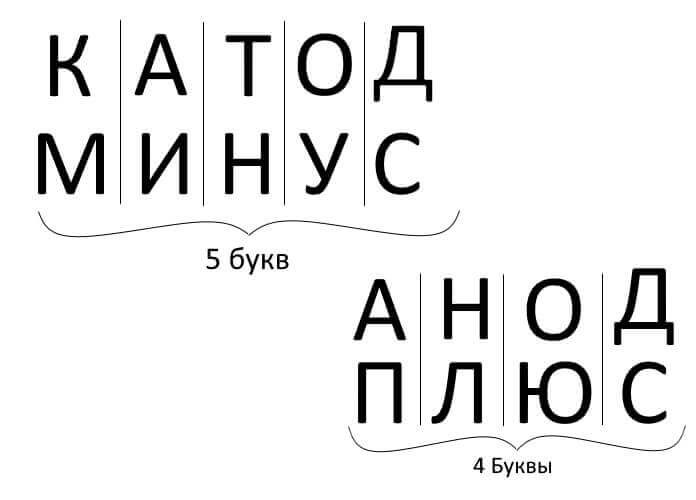
Συνοψίζοντας λοιπόν, απαντώντας στην ερώτηση: πώς να θυμάστε πού είναι το συν, πού είναι το μείον της καθόδου με την άνοδο; Υπάρχει ένας βολικός μνημονικός κανόνας για συσκευές ηλεκτρόλυσης, φόρτισης μπαταρίας, ηλεκτρολυτικής επίστρωσης και ημιαγωγών. Αυτές οι λέξεις με παρόμοια ονόματα έχουν τον ίδιο αριθμό γραμμάτων, όπως φαίνεται παρακάτω:
Σε όλες αυτές τις περιπτώσεις, το ρεύμα ρέει από την κάθοδο και ρέει στην άνοδο.
Μην μπερδεύεστε από τη σύγχυση: «γιατί η κάθοδος είναι θετική για την μπαταρία και όταν φορτίζεται, γίνεται αρνητική;» Θυμηθείτε για όλα τα στοιχεία των ηλεκτρονικών, καθώς και τους ηλεκτρολύτες και στην ηλεκτρολυτική επιμετάλλωση - γενικά, για όλους τους καταναλωτές ενέργειας, η άνοδος είναι η έξοδος που συνδέεται με το συν. Οι διαφορές τελειώνουν εκεί, τώρα είναι πιο εύκολο για εσάς να καταλάβετε ποιο είναι το πλεονέκτημα και το μείον μεταξύ των εξόδων των στοιχείων και των συσκευών.
Τέλος, προτείνουμε να παρακολουθήσετε ένα χρήσιμο βίντεο σχετικά με το θέμα του άρθρου:
Τώρα ξέρετε τι είναι η άνοδος και η κάθοδος, καθώς και πώς να τα θυμάστε αρκετά γρήγορα. Ελπίζουμε ότι οι παρεχόμενες πληροφορίες ήταν χρήσιμες και ενδιαφέρουσες για εσάς!
Σχετικά υλικά: